|
กฎของบอยล์
ความสัมพันธ์ระหว่างปริมาตร ความดัน และอุณหภูมิของแก๊ส

เมื่อทดลองโดยใช้กระบอกฉีดยาและปิดปลายกระบอกฉีดยา เมื่อกดก้านกระบอกฉีดยาทำให้ปริมาตรของแก๊สในกระบอกฉีดยาลดลง และเมื่อปล่อยมือก้านกระบอกฉีดยาจะเลื่อนกลับสู่ตำแหน่งเดิม ในทำนองเดียวกันเมื่อดึงก้านกระบอกฉีดยาขึ้น ทำให้ปริมาตรของแก๊สในกระบอกฉีดเพิ่มขึ้น และเมื่อปล่อยมือก้านกระบอกฉีดยาจะเลื่อนกลับสู่ตำแหน่งเดิม สามารถใช้ทฤษฎีจลน์ของแก๊สอธิบายได้ว่า เมื่อปริมาตรของแก๊สในกระบอกฉีดยาลดลง ทำให้โมเลกุลของแก๊สอยู่ใกล้กันมากขึ้น จึงเกิดการชนกันเองและชนผนังภาชนะมากขึ้น เป็นผลให้ความดันของแก๊สในกระบอกฉีดยาเพิ่มขึ้นเมื่อเทียบกับตอนเริ่มต้น ในทางตรงกันข้ามการเพิ่มปริมาตรของแก๊สในกระบอกฉีดยาทำให้โมเลกุลของแก๊สอยู่ห่างกัน การชนกันเองของโมเลกุลของแก๊สและการชนผนังภาชนะน้อยลง ความดันของแก๊สในกระบอกฉีดยาจึงลดลง
นักวิทยาศาสตร์ได้ทำการทดลองเพื่อศึกษาความสัมพันธ์ระหว่างปริมาตรกับความดันของแก๊ส โดยควบคุมให้อุณหภูมิคงที่ ได้ผลดังตารางต่อไปนี้
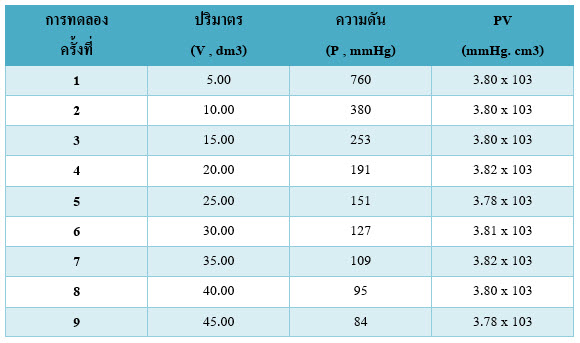
จากผลการทดลองในตารางพบว่า ผลคูณของความดันกับปริมาตร (PV) ของแก๊สในการทดลองแต่ละครั้งมีค่าค่อนข้างคงที่ และเมื่อเขียนกราฟแสดงความสัมพันธ์ระหว่างความดันกับปริมาตรของแก๊สจะได้ดังรูปต่อไปนี้
จากข้อมูลในตารางและจากกราฟพบว่าขณะที่อุณหภูมิคงที่ ถ้าปริมาตรของแก๊สเพิ่มขึ้นจะทำให้ความดันของแก๊สลดลง และเมื่อปริมาตรของแก๊สลดลง ความดันของแก๊สจะเพิ่มขึ้น
โรเบิร์ต บอยล์ (Robert Bolye) นักเคมีชาวอังกฤษ ได้ศึกษาเกี่ยวกับการเปลี่ยนปริมาตรของแก๊สในปี ค.ศ. 1662 (พ.ศ. 2205) และสรุปเป็นกฎเรียกว่า “กฎของบอยล์” ซึ่งมีสาระสำคัญดังนี้
เมื่ออุณหภูมิและมวลของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผกผันกับความดัน



https://sites.google.com/site/topengpjack/reiyn-khemi-xxnlin/khxngkhaeng-khxng-hlw-kaes/kd-khxng-bx-yl-1
|

