
1. เพื่อให้ผู้เรียนสามารถบอกวิธีการและทดลองหาอัตราเร็วของการเกิดปฏิกิริยาเคมี บางชนิด ๆ ได้ บางชนิด ๆ ได้
2. เพื่อให้ผู้เรียนสามารถออกแบบการทดลองเพื่อหาข้อมูลเกี่ยวกับผลของความเข้มข้นและพื้นที่ผิวของสารต่ออัตราการเกิดปฏิกิริยา
3. เพื่อให้ผู้เรียนสามารถออกแบบการทดลองเพื่อพิสูจน์ว่าอุณหภูมิและตัวเร่งปฏิกิริยามีผลต่ออัตราการเกิดปฏิกิริยา
4. อธิบายเหตุผลที่ธรรมชาติของสารเคมีผลต่ออัตราการเกิดปฏิกิริยาเคมีได้
5. เพื่อให้ผู้เรียนสามารถยกตัวอย่างวิธีการที่ใช้ควบคุมอัตราการเกิดปฏิกิริยาในทางอุตสาหกรรมและในชีวิตประจำวันได้

1. กระบอกตวง 10 cm3 1 อัน
2. จุกเกอร์ที่กรีดข้าง 1 อัน
3. บีกเกอร์ขนาด 100 cm3 1 ใบ
4. มีดโกน 1 อัน
5. นาฬิกาจับเวลา 1 เรือน
6. ลวดแมกนีเซียม ยาว 8 cm 1 เส้น
7. สารละลายกรดไฮโดรคลอริกเข้มข้น 0.2 mol/ dm3 15 cm3
8. น้ำกลั่น 50 cm3

1. นำจุกก๊อกขนาดพอดีกับปากกระบอกตวงขนาด 10 cm3 มาบากด้านข้างตามยาวให้เป็นร่องเล็ก ๆ เพื่อให้ของเหลวไหลออกได้และกรีดที่บริเวณกึ่งกลางหน้าตัดจุกก๊อกปลายด้านที่เล็กกว่าให้เป็นรอยยาวประมาณ 0.5 cm
2. นำลวดแมกนีเซียมที่ขัดสะอาดแล้วยาวประมาณ 8 cm ม้วนขดให้เป็นเกลียวคล้ายสปริง จากนั้นเสียบปลายลวดด้านหนึ่งที่รอยกรีดกลางจุกก๊อกในข้อ 1
3. ใส่น้ำกลั่นประมาณ 50 cm3 ในบีกเกอร์ขนาด 100 cm3
4. ใส่สารละลายกรดไฮโดรคลอริก ที่มีความเข้มข้น 2.0 mol/ dm3 ในกระบอกตวงขนาด 10 cm3 จนเต็ม ที่มีความเข้มข้น 2.0 mol/ dm3 ในกระบอกตวงขนาด 10 cm3 จนเต็ม
5. นำจุกก๊อกปิดปากกระบอกตวง แล้วคว่ำกระบอกตวงในบีกเกอร์ที่มีน้ำกลั่นทันที ให้ปากกระบอกตวงอยู่ใต้น้ำ เริ่มต้นจับเวลาเมื่อของเหลวในกระบอกตวงอยู่ที่ 1 cm3 และบันทึกเวลาที่ของเหลวลดลงทุก ๆ 1 cm3 จนกระทั่งของเหลวถึงขีด 8 cm3
6. เขียนกราฟแสดงความสัมพันธ์ระหว่างปริมาตรของแก๊สกับเวลา
7. นำเสนอและสรุปผลการทดลอง

จากผลการทดลองสามารถสรุปผลของการเกิดปฏิกิริยาเคมีได้ดังนี้
| ปริมาตรของ H2 cm3 |
เวลาที่ใช้ (วินาที) |
1
2
3
4
5
6
7 |
80
170
270
390
545
795
1265 |
โดยสามารถเขียนเป็นความสัมพันธ์ระหว่างปริมาตรของแก๊ส H2 กับเวลา ได้ดังนี้
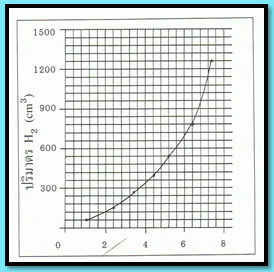
ในช่วงแรกเริ่มของปฏิกิริยา เส้นกราฟจะมีลักษณะใกล้เคียงเส้นตรงแสดงว่าอัตราการเกิด H2 ในตอนเริ่มต้นปฏิกิริยาค่อนข้างคงที่ หลังจากนั้นเส้นกราฟจะมีลักษณะเป็นเส้นโค้งที่มีความชันน้อยลง แสดงว่าปริมาณการเกิดของ H2 จะลดลงเรื่อย ๆ การคำนวณหาอัตราเร็วของการเกิด H2 ที่ช่วงปริมาตรต่าง ๆ ทำได้ดังนี้
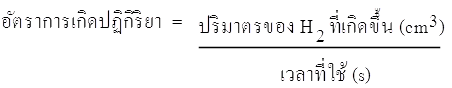
อัตราการเกิด H2 ในช่วงขีดที่ 1-3 cm3 = 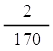 = 1.18 x 10-2 cm3/s = 1.18 x 10-2 cm3/s
อัตราการเกิด H2 ในช่วงขีดที่ 3-5 cm3 = 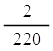 = 9.01 x 10-3 cm3/s = 9.01 x 10-3 cm3/s
อัตราการเกิด H2 ในช่วงขีดที่ 5-7 cm3 = 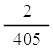 = 4.9 x 10-2 cm3/s = 4.9 x 10-2 cm3/s
อัตราการเกิด H2 ในช่วงขีดที่ 7-8 cm3 = 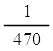 = 4.26 x 10-3 cm3/s = 4.26 x 10-3 cm3/s
อัตราเฉลี่ยของการเกิด H2 = 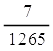 = 5.53 x 1032 cm3/s = 5.53 x 1032 cm3/s
จากผลการทดลองจะสรุปได้ว่าอัตราการเกิดปฏิกิริยาเมื่อเริ่มต้นจะเร็วและจะช้าลงเรื่อย ๆ ตามเวลาที่ผ่านไป แต่อัตราการลดลงไม่คงที่ทำให้ได้เส้นกราฟดังรูป รูปแบบของเส้นกราฟดังกล่าวเรียกว่า กราฟโอกซ์โพเนนเชียล (exponential)
ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยามีทั้งหมด 5 ปัจจัย ได้แก่ ความเข้มข้นของสารเริ่มต้น ,พื้นที่ผิว (ในกรณีที่สารเริ่มต้นเป็นของแข็ง) , อุณหภูมิ , ตัวเร่งปฏิกิริยา และธรรมชาติของสารเริ่มต้น


|

