|

1. เพื่อให้ผู้เรียนสามารถจัดเรียงจำนวนอิเล็กตรอน ในอะตอมของธาตุที่กำหนดให้ได้ ในอะตอมของธาตุที่กำหนดให้ได้
2. บอกเลขหมู่ และ จำนวนเวเลนซ์อิเล็กตรอนของธาตุที่กำหนดให้ได้

ตารางธาตุ ปัจจุบัน ปัจจุบัน
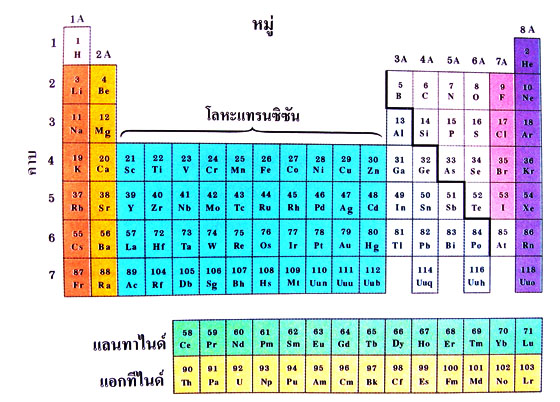
ที่มา : http://www.vcharkarn.com/lesson/1064

จากธาตุต่อไปนี้
| 1. เบอริลเลียม |
5. อาร์กอน |
| 2. โบรอน |
6. โบรมีน |
| 3. ไนโตรเจน |
7. ไอโอดีน |
| 4. แมกนีเซียม |
|
ให้นักเรียนบอกค่าต่าง ๆ ของธาตุตามหัวข้อที่กำหนดให้ดังนี้
1. เลขอะตอม
2. ระดับพลังงานของธาตุ
3. จำนวนเวเลนซ์อิเล็กตรอน

ผลการทดลองที่ได้ คือ
ธาตุ |
เลขอะตอม |
ระดับพลังงานของธาตุ |
จำนวนเวเลนซ์อิเล็กตรอน |
เบอริลเลียม |
4 |
2,2 |
2 |
โบรอน |
5 |
2,3 |
3 |
ไนโตรเจน |
7 |
2,5 |
5 |
แมกนีเซียม |
12 |
2,8,2 |
2 |
ธาตุ |
เลขอะตอม |
ระดับพลังงานของธาตุ |
จำนวนเวเลนซ์อิเล็กตรอน |
อาร์กอน |
18 |
2,8,8 |
8 |
โบรมีน |
35 |
2,8,18,7 |
7 |
ไอโอดีน |
53 |
2,8,18,18,7 |
7 |
สรุปได้ว่า
1. เลขอะตอม คือ ตัวเลขที่แสดงจำนวนโปรตอน
2. อิเล็กตรอนมีการเคลื่อนที่ทำให้อิเล็กตรอนมีพลังงานจลน์  อิเล็กตรอนที่เคลื่อนที่อยู่ในวงกว้างหรือห่างจากนิวเคลียสมากจะมีพลังงานมากกว่าอิเล็กตรอนที่เคลื่อนที่อยู่ในวงใกล้นิวเคลียส จึงสรุปได้ว่า อิเล็กตรอนที่เคลื่อนที่อยู่ในวงโคจรรอบนิวเคลียสมากจะมีจำนวนและพลังงานต่างกัน อาจเรียกแต่ละวงโคจรว่า ระดับพลังงาน ซึ่งแต่ละระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้มากที่สุด เท่ากับ 2n2 เมื่อ n คือ ตัวเลขที่แสดงระดับพลังงานที่อิเล็กตรอนเคลื่อนที่อยู่ อาจเป็น 1, 2, 3, … เมื่อ n= 1 แสดงว่าเป็นวงโคจรหรือระดับพลังงานที่ใกล้นิวเคลียสมากที่สุด และมีจำนวนอิเล็กตรอนได้มากที่สุดเพียง 2 อนุภาคเท่านั้น สำหรับวงโคจรที่ห่างออกไปก็สามารถคำนวณได้ดังนี้ อิเล็กตรอนที่เคลื่อนที่อยู่ในวงกว้างหรือห่างจากนิวเคลียสมากจะมีพลังงานมากกว่าอิเล็กตรอนที่เคลื่อนที่อยู่ในวงใกล้นิวเคลียส จึงสรุปได้ว่า อิเล็กตรอนที่เคลื่อนที่อยู่ในวงโคจรรอบนิวเคลียสมากจะมีจำนวนและพลังงานต่างกัน อาจเรียกแต่ละวงโคจรว่า ระดับพลังงาน ซึ่งแต่ละระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้มากที่สุด เท่ากับ 2n2 เมื่อ n คือ ตัวเลขที่แสดงระดับพลังงานที่อิเล็กตรอนเคลื่อนที่อยู่ อาจเป็น 1, 2, 3, … เมื่อ n= 1 แสดงว่าเป็นวงโคจรหรือระดับพลังงานที่ใกล้นิวเคลียสมากที่สุด และมีจำนวนอิเล็กตรอนได้มากที่สุดเพียง 2 อนุภาคเท่านั้น สำหรับวงโคจรที่ห่างออกไปก็สามารถคำนวณได้ดังนี้
ระดับพลังงานที่ 2 มีอิเล็กตรอนได้ = 2×22=8 อนุภาค
ระดับพลังงานที่ 3 มีอิเล็กตรอนได้ = 2×23=18 อนุภาค
ระดับพลังงานที่ 4 มีอิเล็กตรอนได้ = 2×24=32 อนุภาค
3. อิเล็กตรอนที่อยู่ในระดับพลังงานนอกสุดเรียกว่า เวเลนซ์อิเล็กตรอน ซึ่งมีได้มากที่สุด เท่ากับ 8 อนุภาค


|

