 |
 ปฏิกิริยาเคมี (อังกฤษ: Chemical reaction) คือกระบวนการที่เกิดจากการที่สารเคมีเกิดการเปลี่ยนแปลงแล้วส่งผลให้เกิดสารใหม่ขึ้นมาซึ่งมีคุณสมบัติเปลี่ยนไปจากเดิม โดยมีสารเริ่มต้นปฏิกิริยาเรียกว่า "สารตั้งต้น" (reactant) ซึ่งจะมีเพียงตัวเดียวหรือมากกว่า 1 ตัวก็ได้ มาเกิดปฏิกิริยากัน และทำให้เกิดการเปลี่ยนแปลงในคุณสมบัติทางเคมี ซึ่งก่อตัวขึ้นมาเป็นสารใหม่ที่เรียกว่า "ผลิตภัณฑ์" (product) ในที่สุด สารผลิตภัณฑ์บางตัวอาจมีคุณสมบัติทางเคมีที่ต่างจากสารตั้งต้นเพียงเล็กน้อย แต่ในขณะเดียวกันสารผลิตภัณฑ์บางตัวอาจจะแตกต่างจากสารตั้งต้นของมันโดยสิ้นเชิง ปฏิกิริยาเคมี (อังกฤษ: Chemical reaction) คือกระบวนการที่เกิดจากการที่สารเคมีเกิดการเปลี่ยนแปลงแล้วส่งผลให้เกิดสารใหม่ขึ้นมาซึ่งมีคุณสมบัติเปลี่ยนไปจากเดิม โดยมีสารเริ่มต้นปฏิกิริยาเรียกว่า "สารตั้งต้น" (reactant) ซึ่งจะมีเพียงตัวเดียวหรือมากกว่า 1 ตัวก็ได้ มาเกิดปฏิกิริยากัน และทำให้เกิดการเปลี่ยนแปลงในคุณสมบัติทางเคมี ซึ่งก่อตัวขึ้นมาเป็นสารใหม่ที่เรียกว่า "ผลิตภัณฑ์" (product) ในที่สุด สารผลิตภัณฑ์บางตัวอาจมีคุณสมบัติทางเคมีที่ต่างจากสารตั้งต้นเพียงเล็กน้อย แต่ในขณะเดียวกันสารผลิตภัณฑ์บางตัวอาจจะแตกต่างจากสารตั้งต้นของมันโดยสิ้นเชิง
 แต่เดิมแล้ว คำจำกัดความของปฏิกิริยาเคมีจะเจาะจงไปเฉพาะที่การเคลื่อนที่ของประจุอิเล็กตรอน ซึ่งก่อให้เกิดการสร้างและสลายของพันธะเคมีเท่านั้น แม้ว่าแนวคิดทั่วไปของปฏิกิริยาเคมี โดยเฉพาะในเรื่องของสมการเคมี จะรวมไปถึงการเปลี่ยนสภาพของอนุภาคธาตุ (เป็นที่รู้จักกันในนามของไดอะแกรมฟายน์แมน) และยังรวมไปถึงปฏิกิริยานิวเคลียร์อีกด้วย แต่ถ้ายึดตามคำจำกัดความเดิมของปฏิกิริยาเคมี จะมีปฏิกิริยาเพียง 2 ชนิดคือปฏิกิริยารีดอกซ์ และปฏิกิริยากรด-เบส เท่านั้น โดยปฏิกิริยารีดอกซ์นั้นเกี่ยวกับการเคลื่อนที่ของประจุอิเล็กตรอนเดี่ยว และปฏิกิริยากรด-เบส เกี่ยวกับคู่อิเล็กตรอน แต่เดิมแล้ว คำจำกัดความของปฏิกิริยาเคมีจะเจาะจงไปเฉพาะที่การเคลื่อนที่ของประจุอิเล็กตรอน ซึ่งก่อให้เกิดการสร้างและสลายของพันธะเคมีเท่านั้น แม้ว่าแนวคิดทั่วไปของปฏิกิริยาเคมี โดยเฉพาะในเรื่องของสมการเคมี จะรวมไปถึงการเปลี่ยนสภาพของอนุภาคธาตุ (เป็นที่รู้จักกันในนามของไดอะแกรมฟายน์แมน) และยังรวมไปถึงปฏิกิริยานิวเคลียร์อีกด้วย แต่ถ้ายึดตามคำจำกัดความเดิมของปฏิกิริยาเคมี จะมีปฏิกิริยาเพียง 2 ชนิดคือปฏิกิริยารีดอกซ์ และปฏิกิริยากรด-เบส เท่านั้น โดยปฏิกิริยารีดอกซ์นั้นเกี่ยวกับการเคลื่อนที่ของประจุอิเล็กตรอนเดี่ยว และปฏิกิริยากรด-เบส เกี่ยวกับคู่อิเล็กตรอน
 ในการสังเคราะห์สารเคมี ปฏิกิริยาเคมีต่างๆ จะถูกนำมาผสมผสานกันเพื่อให้เกิดสารผลิตภัณฑ์ที่ต้องการ ในสาขาวิชาชีวเคมี เป็นที่ทราบกันว่า ปฏิกิริยาเคมีหลายๆ ต่อจึงจะก่อให้เกิดแนวทางการเปลี่ยนแปลง (metabolic pathway) ขึ้นมาเนื่องจากการที่จะสังเคราะห์ผลิตภัณฑ์โดยตรงนั้นไม่สามารถทำได้ในตัวเซลล์ในคราวเดียวเนื่องจากพลังงานในเซลล์นั้นไม่พอต่อการที่จะสังเคราะห์ ปฏิกิริยาเคมียังสามารถแบ่งได้เป็นปฏิกิริยาอินทรีย์เคมีและปฏิกิริยาอนินทรีย์เคมี ในการสังเคราะห์สารเคมี ปฏิกิริยาเคมีต่างๆ จะถูกนำมาผสมผสานกันเพื่อให้เกิดสารผลิตภัณฑ์ที่ต้องการ ในสาขาวิชาชีวเคมี เป็นที่ทราบกันว่า ปฏิกิริยาเคมีหลายๆ ต่อจึงจะก่อให้เกิดแนวทางการเปลี่ยนแปลง (metabolic pathway) ขึ้นมาเนื่องจากการที่จะสังเคราะห์ผลิตภัณฑ์โดยตรงนั้นไม่สามารถทำได้ในตัวเซลล์ในคราวเดียวเนื่องจากพลังงานในเซลล์นั้นไม่พอต่อการที่จะสังเคราะห์ ปฏิกิริยาเคมียังสามารถแบ่งได้เป็นปฏิกิริยาอินทรีย์เคมีและปฏิกิริยาอนินทรีย์เคมี
ปฏิกิริยาเคมีจำแนกเป็น 2 ประเภท คือ
 1. ปฏิกิริยาเคมีสมบูรณ์ คือ การเกิดสารใหม่ขณะที่สารตั้งต้นตัวใดตัวหนึ่งหมดไปหรือหมดทุกตัว 1. ปฏิกิริยาเคมีสมบูรณ์ คือ การเกิดสารใหม่ขณะที่สารตั้งต้นตัวใดตัวหนึ่งหมดไปหรือหมดทุกตัว
 2. ปฏิกิริยาเคมีไม่สมบูรณ์ คือ การเกิดสารใหม่ขณะที่สารตั้งต้นยังเหลือทุกตัว ไม่มีตัวใดตัวหนึ่งหมดไป 2. ปฏิกิริยาเคมีไม่สมบูรณ์ คือ การเกิดสารใหม่ขณะที่สารตั้งต้นยังเหลือทุกตัว ไม่มีตัวใดตัวหนึ่งหมดไป
ทฤษฎีที่เกี่ยวข้องกับปฏิกิริยาเคมี
 1. ทฤษฎีการชนโมเลกุล (Collision Theory) กล่าวถึง โมเลกุลของสารต้องมีการชนซึ่งกันและกัน ซึ่งการชนกันแต่ละครั้งไม่จำเป็นต้องเกิดปฏิกิริยา 1. ทฤษฎีการชนโมเลกุล (Collision Theory) กล่าวถึง โมเลกุลของสารต้องมีการชนซึ่งกันและกัน ซึ่งการชนกันแต่ละครั้งไม่จำเป็นต้องเกิดปฏิกิริยา
 2. ทฤษฎีจลน์ของโมเลกุล (Kinetic Theory) กล่าวถึง โมเลกุลต้องมีการเคลื่อนที่ช้าลง ซึ่งก่อให้เกิดพลังงานจลน์ โดยโมเลกุลต้องมีพลังงานสูงพอจึงจะเกิดปฏิกิริยาได้ 2. ทฤษฎีจลน์ของโมเลกุล (Kinetic Theory) กล่าวถึง โมเลกุลต้องมีการเคลื่อนที่ช้าลง ซึ่งก่อให้เกิดพลังงานจลน์ โดยโมเลกุลต้องมีพลังงานสูงพอจึงจะเกิดปฏิกิริยาได้
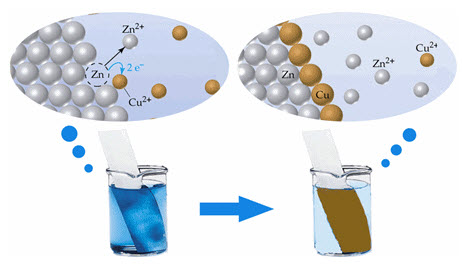
สถานะการเกิดปฏิกิริยาเคมี
 1. ต้องมีจำนวนโมเลกุลมากพอ 1. ต้องมีจำนวนโมเลกุลมากพอ
 2. ต้องมีการชนกันระหว่างโมเลกุล 2. ต้องมีการชนกันระหว่างโมเลกุล
 3. ต้องมีพลังงานสูงพอ โดยอย่างน้อยต้องเท่ากับพลังงานก่อกัมมันต์ 3. ต้องมีพลังงานสูงพอ โดยอย่างน้อยต้องเท่ากับพลังงานก่อกัมมันต์
 4. ต้องมีทิศทางที่เหมาะสม 4. ต้องมีทิศทางที่เหมาะสม
 ศาสตร์ทางเคมีที่เกี่ยวข้องกับการศึกษาอัตราการเกิดปฏิกิริยาเคมี เรียกว่า จลนศาสตร์เคมี (chemical kinetics) โดยคำว่า จลนศาสตร์ มีความหมายเกี่ยวข้องกับการเคลื่อนที่ของสาร ซึ่งเกี่ยวข้องกับอัตราการเกิดปฏิกิริยาเคมี (Rate of chemical reaction) โดยการเกิดปฏิกิริยาหนึ่งๆที่อยู่ในสภาวะเดียวกันจะมีอัตราการเกิดปฏิกิริยาเฉพาะค่า โดยขึ้นอยู่กับสภาวะธรรมชาติของสารนั้นๆ เช่น อัตราการเกิดปฏิกิริยาของก๊าซไฮโดรเจนกับก๊าซฟลูออรีน และก๊าซไนโตรเจน ศาสตร์ทางเคมีที่เกี่ยวข้องกับการศึกษาอัตราการเกิดปฏิกิริยาเคมี เรียกว่า จลนศาสตร์เคมี (chemical kinetics) โดยคำว่า จลนศาสตร์ มีความหมายเกี่ยวข้องกับการเคลื่อนที่ของสาร ซึ่งเกี่ยวข้องกับอัตราการเกิดปฏิกิริยาเคมี (Rate of chemical reaction) โดยการเกิดปฏิกิริยาหนึ่งๆที่อยู่ในสภาวะเดียวกันจะมีอัตราการเกิดปฏิกิริยาเฉพาะค่า โดยขึ้นอยู่กับสภาวะธรรมชาติของสารนั้นๆ เช่น อัตราการเกิดปฏิกิริยาของก๊าซไฮโดรเจนกับก๊าซฟลูออรีน และก๊าซไนโตรเจน
  H2 (g) + F2 (g) = 2HF อัตราการเกิดปฏิกิริยาเร็ว H2 (g) + F2 (g) = 2HF อัตราการเกิดปฏิกิริยาเร็ว
  3H2 (g) + N2 (g) = 2NH3 อัตราการเกิดปฏิกิริยาช้า 3H2 (g) + N2 (g) = 2NH3 อัตราการเกิดปฏิกิริยาช้า

https://th.wikipedia.org/wiki/ปฏิกิริยาเคมี
http://scimath.org/lesson-chemistry/item/7203-2017-06-09-13-16-10
|

