|
 จุดเดือดจุดหลอมเหลวของธาตุ ขึ้นอยู่กับแรงดึงดูดระหว่างโมเลกุลหรืออะตอม ถ้าแรงดึงดูดระหว่างโมเลกุลหรืออะตอมมาก จะมีจุดหลอมเหลวสูง แต่ถ้าแรงดึงดูดระหว่างโมเลกุลน้อย จุดเดือดจุดหลอมเหลวจะต่ำ จุดเดือดจุดหลอมเหลวของธาตุ ขึ้นอยู่กับแรงดึงดูดระหว่างโมเลกุลหรืออะตอม ถ้าแรงดึงดูดระหว่างโมเลกุลหรืออะตอมมาก จะมีจุดหลอมเหลวสูง แต่ถ้าแรงดึงดูดระหว่างโมเลกุลน้อย จุดเดือดจุดหลอมเหลวจะต่ำ
ธาตุโลหะ แรงดึงดูดระหว่างอะตอม เป็นพันธะโลหะ มีจุดเดือดจุดหลอมเหลวสูง ความแข็งแรงของพันธะโลหะขึ้นอยู่กับขนาดของอะตอม
 -ถ้าอะตอมมีขนาดเล็กพันธะโลหะจะมีความแข็งแรงมากกว่าขนาดอะตอมใหญ่ -ถ้าอะตอมมีขนาดเล็กพันธะโลหะจะมีความแข็งแรงมากกว่าขนาดอะตอมใหญ่
 -ธาตุที่มีระดับพลังงานเท่ากัน ความแรงของพันธะโลหะขึ้นอยู่กับจำนวนเวเลนซ์อิเล็กตรอน คือ โลหะที่มีจำนวนเวเลนซ์อิเล็กตรอนมากกว่าจะมีความแรงของพันธะโลหะมากกว่า โลหะใดมีความแรงของพันธะโลหะมาก จุดเดือดจุดหลอมเหลวก็จะสูงและถ้าโลหะใดมีความแรงของพันธะโลหะน้อย มาก จุดเดือดจุดหลอมเหลวก็จะต่ำด้วย -ธาตุที่มีระดับพลังงานเท่ากัน ความแรงของพันธะโลหะขึ้นอยู่กับจำนวนเวเลนซ์อิเล็กตรอน คือ โลหะที่มีจำนวนเวเลนซ์อิเล็กตรอนมากกว่าจะมีความแรงของพันธะโลหะมากกว่า โลหะใดมีความแรงของพันธะโลหะมาก จุดเดือดจุดหลอมเหลวก็จะสูงและถ้าโลหะใดมีความแรงของพันธะโลหะน้อย มาก จุดเดือดจุดหลอมเหลวก็จะต่ำด้วย
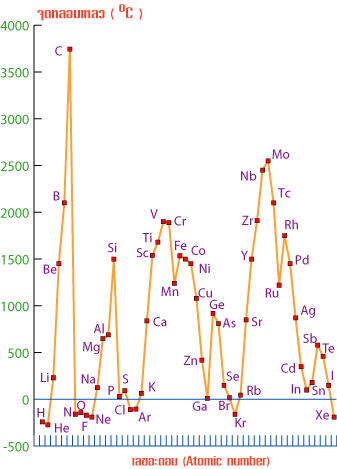 |
| รูปที่ 1 กราฟจุดเดือดจุดหลอมเหลวของธาตุในตารางธาตุ |
จากกราฟแนวโน้มจุดเดือดจุดหลอมเหลวของธาตุในหมู่เดียวกัน จากบนลงล่าง เป็นดังนี้
1.ธาตุที่เป็นโลหะ
 – จุดเดือดจุดหลอมเหลวลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดอะตอมมีขนาดใหญ่ขึ้น – จุดเดือดจุดหลอมเหลวลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดอะตอมมีขนาดใหญ่ขึ้น
 -โลหะทุกชนิดมีจุดเดือดจุดหลอมเหลวกว้าง คือห่างกันมาก เช่น -โลหะทุกชนิดมีจุดเดือดจุดหลอมเหลวกว้าง คือห่างกันมาก เช่น
  Fe มี mp = 1535 ๐C และBp = 2750 ๐C Fe มี mp = 1535 ๐C และBp = 2750 ๐C
  มีจุดเดือดห่างจากจุดหลอมเหลว 2750-1535 ๐C = 1215 ๐C มีจุดเดือดห่างจากจุดหลอมเหลว 2750-1535 ๐C = 1215 ๐C
2.ธาตุเป็นอโลหะ
 -จุดเดือดจุดหลอมเหลวเพิ่มขึ้นเมื่อเลขอะตอมลดลง เนื่องจากมวลอะตอมมีค่าเพิ่มขึ้น ทำให้แรงดึงดูดระหว่างโมเลกุลมีค่าเพิ่มขึ้น -จุดเดือดจุดหลอมเหลวเพิ่มขึ้นเมื่อเลขอะตอมลดลง เนื่องจากมวลอะตอมมีค่าเพิ่มขึ้น ทำให้แรงดึงดูดระหว่างโมเลกุลมีค่าเพิ่มขึ้น
 – อโลหะทุกชนิดมีจุดเดือดจุดหลอมเหลวแคบ คือห่างกันน้อย เช่น – อโลหะทุกชนิดมีจุดเดือดจุดหลอมเหลวแคบ คือห่างกันน้อย เช่น
  Cl มีจุดเดือดห่างจากจุดหลอมเหลว = (-35) – (-102) = 67 ๐C Cl มีจุดเดือดห่างจากจุดหลอมเหลว = (-35) – (-102) = 67 ๐C
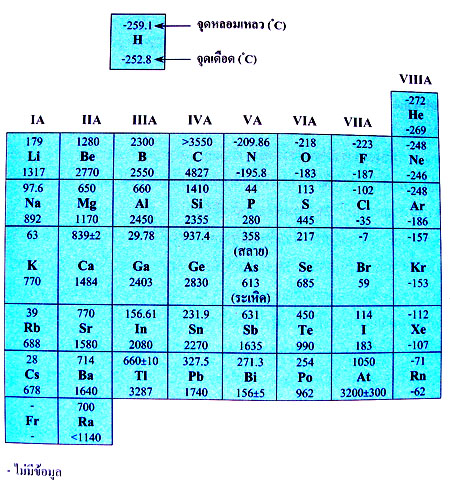 |
| รูปที่ 2 ตารางจุดเดือดจุดหลอมเหลวของธาตุในตารางธาตุ |
 -จุดเดือดจุดหลอมเหลวของธาตุในหมู่ IA IIA IIIA และ IVA เป็นโลหะ ยึดเหนี่ยวดัวยพันธะโลหะ มีแนวโน้มสูงขึ้นตามลำดับ โดยเฉพาะหมู่ IVA จะมีจุดเดือดจุดหลอมเหลวสูงที่สุด เมื่อเลขอะตอมเพิ่มขึ้น จะมีเวเลนซ์อิเล็กตรอนมากขึ้น มีแรงยึดเหนี่ยวระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนที่เคลื่อนที่อิสระแข็งแรงขึ้น ธาตุหมู่ IVA บางธาตุมีโครงสร้างเป็นผลึกร่างตาข่ายจึงทำให้มีจุดเดือดจุดหลอมเหลวสูงเช่น C -จุดเดือดจุดหลอมเหลวของธาตุในหมู่ IA IIA IIIA และ IVA เป็นโลหะ ยึดเหนี่ยวดัวยพันธะโลหะ มีแนวโน้มสูงขึ้นตามลำดับ โดยเฉพาะหมู่ IVA จะมีจุดเดือดจุดหลอมเหลวสูงที่สุด เมื่อเลขอะตอมเพิ่มขึ้น จะมีเวเลนซ์อิเล็กตรอนมากขึ้น มีแรงยึดเหนี่ยวระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนที่เคลื่อนที่อิสระแข็งแรงขึ้น ธาตุหมู่ IVA บางธาตุมีโครงสร้างเป็นผลึกร่างตาข่ายจึงทำให้มีจุดเดือดจุดหลอมเหลวสูงเช่น C
 – หมู่ VA VIA VIIA VIIIA เป็นอโลหะยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์ มีจุดเดือดจุดหลอมเหลวต่ำ เนื่องจากแรงยึดเหนี่ยวระหว่างโมเลกุลของธาตุกลุ่มนี้มีค่าต่ำมาก – หมู่ VA VIA VIIA VIIIA เป็นอโลหะยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์ มีจุดเดือดจุดหลอมเหลวต่ำ เนื่องจากแรงยึดเหนี่ยวระหว่างโมเลกุลของธาตุกลุ่มนี้มีค่าต่ำมาก
 – ธาตุที่มีความเป็นโลหะกับอโลหะปนกันเรียกว่ากึ่งโลหะมี 8 ตุ คือ B, Si, Ge, As, Sb, Te, Po และ At – ธาตุที่มีความเป็นโลหะกับอโลหะปนกันเรียกว่ากึ่งโลหะมี 8 ตุ คือ B, Si, Ge, As, Sb, Te, Po และ At
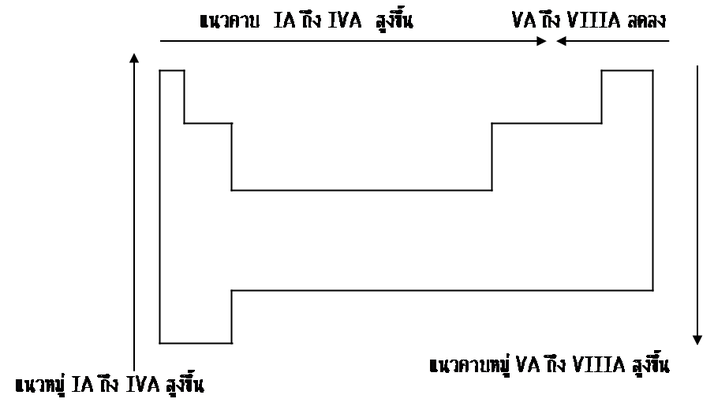
สรุปแนวโน้มจุดเดือดจุดหลอมเหลวของธาตุ
 1.ธาตุโลหะ 1.ธาตุโลหะ
 - ธาตุในหมู่เดียวกัน จุดเดือดจุดหลอมเหลวของโลหะหมู่เดียวกัน ได้แก่ธาตุ หมู่ที่ IA IIA IIIA และ IVA จะลดลงจากบนลงล่าง(เพิ่มขึ้นจากล่างขึ้นบน)เพราะธาตุข้างบนมีขนาดอะตอมเล็ก พันธะโลหะจึงแข็งแรงมากกว่าธาตุข้างล่าง ( เมื่อเลขอะตอมเพิ่มขึ้นจุดเดือดจุดหลอมเหลวจะลดลง ) - ธาตุในหมู่เดียวกัน จุดเดือดจุดหลอมเหลวของโลหะหมู่เดียวกัน ได้แก่ธาตุ หมู่ที่ IA IIA IIIA และ IVA จะลดลงจากบนลงล่าง(เพิ่มขึ้นจากล่างขึ้นบน)เพราะธาตุข้างบนมีขนาดอะตอมเล็ก พันธะโลหะจึงแข็งแรงมากกว่าธาตุข้างล่าง ( เมื่อเลขอะตอมเพิ่มขึ้นจุดเดือดจุดหลอมเหลวจะลดลง )
 - ธาตุในคาบเดียวกัน จุดเดือดจุดหลอมเหลวของโลหะจะเพิ่มขึ้นจากหมู่ที่ IA ถึงหมู่ที่ IIIA เพราะขนาดอะตอมเล็กลง ( เมื่อเลขอะตอมเพิ่มขึ้นจุดเดือดจุดหลอมเหลวจะสูงขึ้น โดยเฉพาะ หมู่ที่ IVA จะมีจุดเดือดและจุดหลอมเหลวสูงที่สุด เพราะบางธาตุมีโครงสร้างยึดเหนี่ยวกันด้วยพันธะโคเวเลนซ์ เป็นโครงผลึกร่างตาข่าย เช่น C Si ซึ่งเป็นโครงสร้างที่แข็งแรงกว่าพันธะโลหะ ) - ธาตุในคาบเดียวกัน จุดเดือดจุดหลอมเหลวของโลหะจะเพิ่มขึ้นจากหมู่ที่ IA ถึงหมู่ที่ IIIA เพราะขนาดอะตอมเล็กลง ( เมื่อเลขอะตอมเพิ่มขึ้นจุดเดือดจุดหลอมเหลวจะสูงขึ้น โดยเฉพาะ หมู่ที่ IVA จะมีจุดเดือดและจุดหลอมเหลวสูงที่สุด เพราะบางธาตุมีโครงสร้างยึดเหนี่ยวกันด้วยพันธะโคเวเลนซ์ เป็นโครงผลึกร่างตาข่าย เช่น C Si ซึ่งเป็นโครงสร้างที่แข็งแรงกว่าพันธะโลหะ )
 2.ธาตุอโลหะ แรงดึงดูดระหว่างโมเลกุลเป็น แรงแวนเดอร์วาลส์ ซึ่งขึ้นอยู่กับมวลโมเลกุลและขนาดโมเลกุล ถ้าธาตุอโลหะใดมีมวลโมเลกุลสูง ก็จะมีแรงแวนเดอร์วาลส์มาก ทำให้จุดเดือดจุดหลอมเหลว สูงและถ้ามวลโมเลกุลต่ำ จุดเดือด จุดหลอมเหลวก็จะต่ำด้วยจุดเดือดจุดหลอมเหลวต่ำ จุดเดือดจุดหลอมเหลวขึ้นอยู่กับแรงวันเดอร์วาลส์ 2.ธาตุอโลหะ แรงดึงดูดระหว่างโมเลกุลเป็น แรงแวนเดอร์วาลส์ ซึ่งขึ้นอยู่กับมวลโมเลกุลและขนาดโมเลกุล ถ้าธาตุอโลหะใดมีมวลโมเลกุลสูง ก็จะมีแรงแวนเดอร์วาลส์มาก ทำให้จุดเดือดจุดหลอมเหลว สูงและถ้ามวลโมเลกุลต่ำ จุดเดือด จุดหลอมเหลวก็จะต่ำด้วยจุดเดือดจุดหลอมเหลวต่ำ จุดเดือดจุดหลอมเหลวขึ้นอยู่กับแรงวันเดอร์วาลส์
 -ธาตุในหมู่เดียวกัน จุดเดือดจุดหลอมเหลวของอโลหะหมู่ VA ถึงหมู่ ที่ VIIIA จะเพิ่มขึ้นจากบนลงล่าง (เมื่อเลขอะตอมเพิ่มขึ้นจุดเดือดจุดหลอมเหลวจะสูงขึ้น) -ธาตุในหมู่เดียวกัน จุดเดือดจุดหลอมเหลวของอโลหะหมู่ VA ถึงหมู่ ที่ VIIIA จะเพิ่มขึ้นจากบนลงล่าง (เมื่อเลขอะตอมเพิ่มขึ้นจุดเดือดจุดหลอมเหลวจะสูงขึ้น)
 -ธาตุในคาบเดียวกัน จุดเดือดจุดหลอมเหลวของอโลหะจะลดลงจากหมู่ที่ VA ถึงหมู่ที่ VIIIA ( เมื่อเลขอะตอมเพิ่มขึ้นจุดเดือดจุดหลอมเหลวจะต่ำลง ) โดยเฉพาะหมู่ที่ VIIIA จะมีจุดเดือดและจุดหลอมเหลวต่ำที่สุดเนื่องจากมีพันธะโคเวเลนซ์ -ธาตุในคาบเดียวกัน จุดเดือดจุดหลอมเหลวของอโลหะจะลดลงจากหมู่ที่ VA ถึงหมู่ที่ VIIIA ( เมื่อเลขอะตอมเพิ่มขึ้นจุดเดือดจุดหลอมเหลวจะต่ำลง ) โดยเฉพาะหมู่ที่ VIIIA จะมีจุดเดือดและจุดหลอมเหลวต่ำที่สุดเนื่องจากมีพันธะโคเวเลนซ์

https://dangwansri.wordpress.com/หน้าแรก/กิจกรรม-2/
|

