|
 โมเลกุลของน้ำประกอบด้วยออกซิเจน 1 อะตอม จับกับไฮโดรเจน 2 อะตอม โดยพันธะโควาเลนต์ และการที่อะตอมของออกซิเจนมีอิเลคโตเนกาติวิตี (electronegativity) มากกว่าไฮโดรเจน โมเลกุลของน้ำจึงมีขั้ว 2 ขั้ว (dipole) โดยอะตอมของไฮโดรเจนจะเป็นบวกเล็กน้อย ขณะที่อะตอมของออกซิเจนจะเป็นลบเล็กน้อย และเนื่องจากโมเลกุลของน้ำมีการกระจายประจุไม่สมดุล พันธะระหว่างออกซิเจนและไฮโดรเจนจึงไม่เป็นเส้นตรง มุมระหว่างพันธะในโมเลกุลเดี่ยวของน้ำในสถานะไอจะมีค่า 104.5 องศา และมีการกระจายของประจุรอบๆ โมเลกุลของน้ำ เป็นมุมที่ใกล้เคียงกับมุมเตตระฮีดรัลคือ 105 องศา ความยาวของพันธะระหว่างไฮโดรเจนกับออกซิเจนอะตอมคือ 0.096 นาโนเมตร ดังรูป โมเลกุลของน้ำประกอบด้วยออกซิเจน 1 อะตอม จับกับไฮโดรเจน 2 อะตอม โดยพันธะโควาเลนต์ และการที่อะตอมของออกซิเจนมีอิเลคโตเนกาติวิตี (electronegativity) มากกว่าไฮโดรเจน โมเลกุลของน้ำจึงมีขั้ว 2 ขั้ว (dipole) โดยอะตอมของไฮโดรเจนจะเป็นบวกเล็กน้อย ขณะที่อะตอมของออกซิเจนจะเป็นลบเล็กน้อย และเนื่องจากโมเลกุลของน้ำมีการกระจายประจุไม่สมดุล พันธะระหว่างออกซิเจนและไฮโดรเจนจึงไม่เป็นเส้นตรง มุมระหว่างพันธะในโมเลกุลเดี่ยวของน้ำในสถานะไอจะมีค่า 104.5 องศา และมีการกระจายของประจุรอบๆ โมเลกุลของน้ำ เป็นมุมที่ใกล้เคียงกับมุมเตตระฮีดรัลคือ 105 องศา ความยาวของพันธะระหว่างไฮโดรเจนกับออกซิเจนอะตอมคือ 0.096 นาโนเมตร ดังรูป
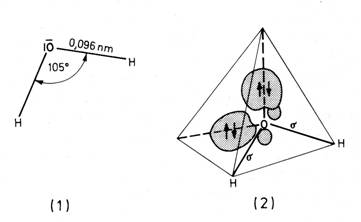
โครงสร้างโมเลกุลของน้ำ (1) โครงสร้างโมเลกุลทางเรขาคณิต (2) วงโคจรของประจุรอบๆโมเลกุลเป็นรูปเตตระฮีดรัลในสามมิติ
 การมีขั้วของน้ำและการกระจายประจุแบบเตตระฮีดรัล ทำให้แต่ละโมเลกุลของน้ำที่อยู่ในสถานะของเหลวและของแข็ง สามารถยึดเกาะกับน้ำได้อีก 4 โมเลกุลด้วยพันธะไฮโดรเจน เกิดการเรียงตัวเป็น 3 มิติ ในรูปแบบเตตระฮีดรัล ดังรูป การมีขั้วของน้ำและการกระจายประจุแบบเตตระฮีดรัล ทำให้แต่ละโมเลกุลของน้ำที่อยู่ในสถานะของเหลวและของแข็ง สามารถยึดเกาะกับน้ำได้อีก 4 โมเลกุลด้วยพันธะไฮโดรเจน เกิดการเรียงตัวเป็น 3 มิติ ในรูปแบบเตตระฮีดรัล ดังรูป
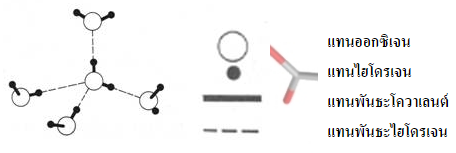
การยึดเกาะระหว่างโมเลกุลของน้ำโดยพันธะไฮโดรเจน
 สำหรับน้ำที่อยู่ในสถานะเป็นของเหลว บางครั้งอาจมีจำนวนโมเลกุลของน้ำที่จับกันด้วยพันธะไฮโดรเจนเพิ่มขึ้น พันธะไฮโดรเจนมีพลังงาน 2 - 40 กิโลจูล/โมล ซึ่งมีค่าน้อยเมื่อเทียบกับพันธะโควาเลนต์ระหว่างออกซิเจนกับไฮโดรเจน ซึ่งมีค่าถึง 335 กิโลจูล/โมล แต่เนื่องจากมีโมเลกุลของน้ำยึดเหนี่ยวกันด้วยพันธะไฮโดรเจนจำนวนมาก จึงทำให้น้ำมีสมบัติแตกต่างจากสารอื่น ที่น้ำหนักโมเลกุลใกล้เคียงกันค่อนข้างมาก สำหรับน้ำที่อยู่ในสถานะเป็นของเหลว บางครั้งอาจมีจำนวนโมเลกุลของน้ำที่จับกันด้วยพันธะไฮโดรเจนเพิ่มขึ้น พันธะไฮโดรเจนมีพลังงาน 2 - 40 กิโลจูล/โมล ซึ่งมีค่าน้อยเมื่อเทียบกับพันธะโควาเลนต์ระหว่างออกซิเจนกับไฮโดรเจน ซึ่งมีค่าถึง 335 กิโลจูล/โมล แต่เนื่องจากมีโมเลกุลของน้ำยึดเหนี่ยวกันด้วยพันธะไฮโดรเจนจำนวนมาก จึงทำให้น้ำมีสมบัติแตกต่างจากสารอื่น ที่น้ำหนักโมเลกุลใกล้เคียงกันค่อนข้างมาก

 http://coursewares.mju.ac.th:81/e-learning50/FT320/012.htm http://coursewares.mju.ac.th:81/e-learning50/FT320/012.htm
|

